SUPERCONDUCTIVITY COMMUNICATIONS, Vol.21, No2 April, 2012
SQUID バイオ免疫検査装置の開発動向 _九州大学_
ナノメータサイズの磁気微粒子を高分子で被覆し、その表面に検査用抗体や薬剤を結合したものは磁気マーカーと呼ばれており、蛋白質や細胞の分離・精製、及び MRI の造影剤として医療・バイオ分野で広く用いられている。この磁気マーカーと SQUID 磁気センサを組み合わせて、疾患由来の蛋白質やガン細胞などのバイオ物質を磁気的に検出する新しい免疫検査装置の開発研究が行なわれている。 SQUID バイオ免疫検査装置の最近の開発動向について九州大学の圓福教授に聞いた。
磁気的な免疫検査法では、磁気マーカーとバイオ物質の結合反応を磁気マーカーからの磁気信号を測定することにより検出する。磁気信号の検出には GMR 磁気センサなどが一般に用いられており、集積化技術を用いたバイオチップも開発されている (R. Gaster et al ., Nat. Nanotechnol ., 6 (2011) 314) 。しかしながら、 極微量な結合反応を検出するためには微弱磁界を検出できる SQUID 磁気センサが最適であり、 SQUID を用いた超高感度なバイオ免疫検査装置の開発に期待が寄せられている。
図 1 に 血液検査等の体外診断を目指した液相免疫検査法を示す。 図 1(a) に示すように、溶液中にはバイオ物質と結合した結合 (Bound) マーカーと未結合 (Free) マーカーが共存している。磁気特性の違いを利用することのより両者を 磁気的に識別できるため、両者が混在した状態でも免疫検査が可能となる。すなわち、 従来の 光学的手法で必要とされていた B/F(Bound/Free) 分離のための時間と手間を要する洗浄工程を省くことが出来る。この検査法は液相検査と呼ばれており、迅速・高感度な検査を可能とする。
この液相検査法のための HTS SQUID システムが多くの研究機関で開発されている。このシステムを用いて種々の蛋白質や病原菌等の検出が行なわれており、極微量なバイオ物質の高感度検出が可能なことが示されている。 一例を図 1 (b) に示す (H. Kuma et al ., Clin Chem Lab Med , 48 (2010) 1263 )。アレルギー疾患に関連した IgE と呼ばれる蛋白質を検出した結果である。 図の横軸は IgE の重さ w をモル数で表し、縦軸は SQUID センサで検出した磁束信号 F s を表している。▲印は B/F 分離を行なわない液相検査の結果であり、 ○ 印は B/F 分離を行なった結果である。同図に示すように、 B/F 分離の有無に係わらず同一の結果が得られている。また、アトモルレベルの極微量な検出が可能であることが示されている。 なお、台湾のベンチャー企業 ( MagQu) が HTS SQUID を用いた検査システムを開発し、本手法による結果が従来の光学的手法 (ELISA) の結果と定量的に一致すること、及び従来法よりも高感度検出が可能であることを示している(http://www.magqu.com/) 。
また、液相検査法では 結合 (Bound) マーカーと未結合 (Free) マーカーが共存した状態での検査が可能なため、 抗原―抗体の結合反応の時間経過を計測できる。このため、反応過程のその場観察や抗体の活性度等の詳細な解析が可能となる。このような反応過程の動特性を計測できる検査法は kinetic immunoassay と呼ばれており、これまでに無い新しい検査法として注目されている。
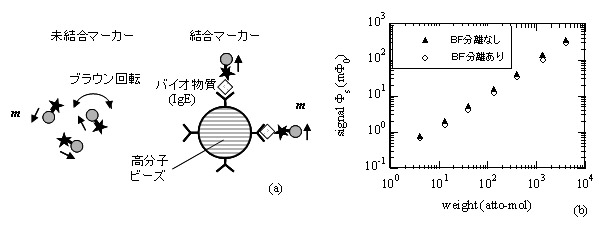
図 1. (a) 磁気マーカーを用いた液相免疫検査法。 (b) 蛋白質( IgE )の検査例。
図 2 は免疫検査の体内診断への展開を示している。磁気信号は体内を透過するた め、体内での 抗原―抗体の 結合反応を計測することが出来、免疫検査を体内診断へと展開することが可能となる。 図 2(a) は磁気マーカーを用いた乳がんのセンチネルリンパ節生検への応用を示している。図に示すように磁気マーカーを体内の患部 ( ガン細胞 ) に注入すると、マーカーはリンパ管を経由して最初のリンパ節 ( センチネルリンパ節 ) に到達する。ガン細胞がこのリンパ節に達していれば、磁気マーカーはガン細胞と結合しこの場所に集積する。従って、リンパ節に集積した磁気マーカーからの磁気信号を体表面で計測することによりガン細胞の広がりを検査できる。このように、体内に集積した磁気マーカーの量と位置を検出し体内診断を行なう検査法は、一般に Magnetic Particle Imaging (MPI) と呼ばれている。
磁気マーカーイメージングの模擬実験の結果を図 2 に示す。実験では図 2(b) に示すように、深さ z =20 mm の位置にあり、距離 D x =20 mm 離れた二つの磁気マーカー ( サイズ 5 mm f 、重さ 100 m g) の検出を行なっている。図 2(c) は z =0 mm で測定した信号磁界マップの測定結果である。同図に示すように二つの磁気マーカーの直上で磁界のピーク値が得られており、この場所に磁気マーカーがあることが分かる。ただし、図 2(c) に示すように磁界マップは空間的に広がっており、マーカーの位置を推定する際の空間分解能はあまり高くない。空間分解能を高めるため、磁界マップのデータを数学的に解析し、磁気マーカーの分布を求める方法が多く開発されている。図 2(d) は特異値分解法 (SVD) と呼ばれる手法を用いて、磁界マップから磁気マーカーの分布を求めた結果である。同図に示すように二つの磁気マーカーが明瞭に区別されている。この様にして、体内に集積した磁気マーカーの位置と量を正確に検出することができる。
なお、乳がんのセンチネルリンパ節検査については、 HTS SQUID を用いたシステム ( SentiMag ) が米国ヒューストンの TcSUH で開発されており、既に臨床応用に適用されている段階である (http://tcsuh.net/research/lymph-node-staging/) 。また、多チャンネル SQUID を用いた乳がんの検出のための検査システムも開発中である( H. J. Hathaway et al ., Breast Cancer Research , 13 (2011) R108 )。
圓福教授によれば、「磁気マーカーと SQUID センサを組み合わせた免疫検査法は、従来の光学的手法にはない高感度性と多くの新機能を有しており、新しいバイオ診断機器として早期の実用化を期待している。」とのことである。( @SQUID )
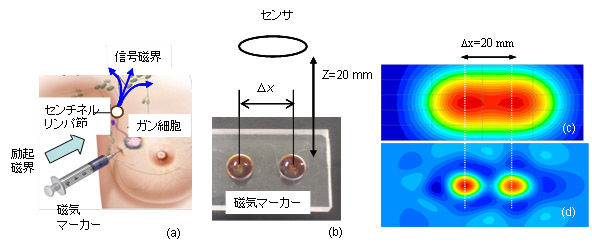
図 2. (a) 磁気マーカーを用いたセンチネルリンパ節検査、 (b) 磁気マーカーの検出、 (c) 磁界マッピング、 (d) 磁気マーカーのイメージング。 z =20 mm の深さにあり、 D x =20 mm だけ離れた重さ 100 m g の二つの磁気マーカーを検出 ( 九州大学の圓福教授等の結果 ) 。